Ольга Матвеева (с участием коллег)
По замыслу разработчиков пептиды «ЭпиВакКороны» содержат В-клеточные эпитопы. Я и Маргарита Романенко очень заинтересовались вопросом соответствия пептидов Вектора линейным B-клеточным эпитопам шиповидного белка, и паралелльно мы нашли одни и те же работы с описанием эпитопного картирования, на основании результатов которого можно было бы судить о таком соответствии.
Экспериментальным поиском линейных B-клеточных эпитопов шиповидного белка занималось сразу несколько независимых лабораторий. Исследователи из разных стран независимо друг от друга провели скрининговое картирование почти всех пептидных фрагментов шиповидного белка с целью поиска тех, с которыми будут связываться антитела как можно большего количества реконвалесцентов.
Эксперимент был построен так: на подложку последовательно, по принципу черепичной укладки, иммобилизуют пептиды шиповидного белка. Таких подложек готовится много. Потом на каждую подложку наливается плазма из крови выздоровевших больных после COVID-19 людей. Далее, после образования комплекса пептид–антитело, методом иммуноферментного анализа, происходит идентификация пептидов, с которыми связались антитела. После первичного картирования и выявления пептидов шиповидного белка, которые узнаются антителами, следует вторая фаза исследования. В этой фазе экспериментально устанавливают, какие пептиды способны помешать реакции нейтрализации вируса сывороткой переболевших.
При таком систематическом скрининге были обнаружены участки шиповидного белка, с которыми связываются антитела переболевших COVID-19. У разных людей выявляются разные участки, но есть общие закономерности. Некоторые пептиды соответствуют “слепым или полу-слепым зонам” иммунитета (на соответствующие участки шиповидного белка крайне редко образуются антитела). Некоторые наоборот соответствуют “острому зрению” иммунитета, то есть образованию антител, у многих людей перенесших COVID-19. Были найдены фрагменты шиповидного белка, связывание которых с антителами приводит к нейтрализации вируса.
Участки молекулы шиповидного белка, выбранные Вектором для пептидной вакцины как линейные B-клеточные эпитопы, на самом деле находятся в “полу-слепой зоне” иммунной системы человека. На них антитела образуются крайне редко.
Участки шиповидного белка, на которые антитела часто детектируются у реконвалесцентов показаны на карте аминокислотной последовательности на рисунке ниже. Эти участки обозначены по-разному в зависимости от публикации, из которой взята информация. Пептиды Вектора, входящие в состав ЭпиВакКороны (обозначены лиловым цветом и цифрами 1,2 и 3), не перекрываются с этими участками. На них антитела если и образуются, то редко. Участки на которые способны образоваться нейтрализующие антитела подчеркунуты синими прямоугольниками.
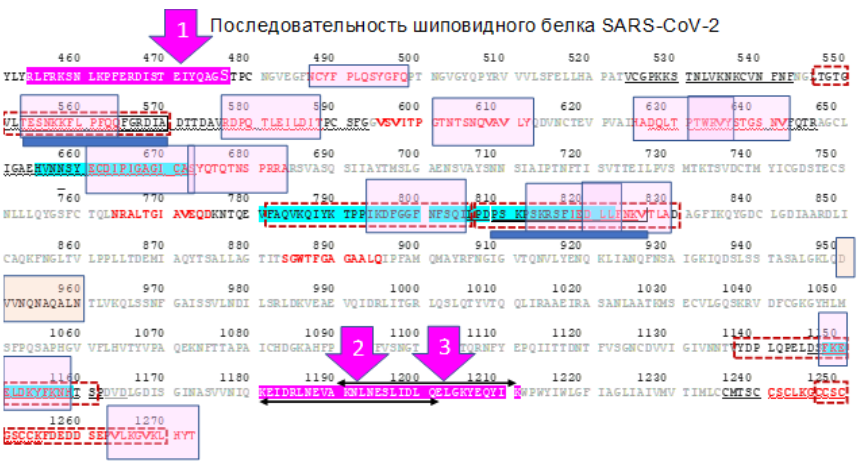
Много ли линейных эпитопов в шиповидном белке? Огромная часть В-клеточных эпитопов являются конформационными: В-клеточный рецептор BCR распознает поверхностный паттерн белка, а не линейный пептид в комплексе с молекулой HLA, как Т-клеточные рецепторы. Таким образом, линейных эпитопов в белках, как правило, меньше, чем конфармационных.
Интересно то, что на рецептор-связывающий мотив (РБМ) шиповидного белка у больных COVID-19 образуется широкий спектр нейтрализующих антител, однако большинство этих антител, ожидаемо, взаимодействуют с конформационными эпитопами. Так авторы работы (4), проанализировавшие сыворотки более чем тысячи реконвалесцентов, пишут что результаты их работы убедительно подтверждают, что рецептор-связывающий домен шиповидного белка богат именно конформационными эпитопами. Линейные эпитопы в этом районе, вызывают образование антител у очень малого количества людей. Нижеследующая таблица показывает проценты переболевших ковидом у которых выработались антитела на фрагменты шиповидного белка, которые перекрываются с пептидами Вектора.
| Начало участка | Пептид | Конец участка | Процент реконвалесцентов с антителами | Средний сигнал в контрольной группе | Средний сигнал в группе реконвалесцентов |
|---|---|---|---|---|---|
| Рецептор связывающий мотив у Вектора 454 RLFRKSNLKPFERDISTEIYQAGS 477M | |||||
| 451 | YLYRLFRKSNLK | 462 | 5.7% | 41.5±113.6 | 156.5±919.6 |
| 457 | RKSNLKPFERDI | 468 | 1.2% | 5.9±16.2 | 48.5±502.8 |
| 463 | PFERDISTEIYQ | 474 | 2.2% | 19.5±141.4 | 173.5±1659.6 |
| 469 | STEIYQAGSTPC | 480 | 0.0% | 13.6±44.7 | 22.2±51.6 |
| Гепта-повтор 2 у Вектора 1181 KEIDRLNEVAKNLNESLIDLQE 1201; 1191 KNLNESLIDLQELGKYEQYIK 1211 | |||||
| 1178 | NIQKEIDRLNEV | 1189 | 7.2% | 7.9±27.4 | 147.8±780.6 |
| 1184 | DRLNEVAKNLNE | 1195 | 1.2% | 6.3±42.1 | 36.7±117.1 |
| 1190 | AKNLNESLIDLQ | 1201 | 10.5% | 62.2±117 | 148.2±379 |
| 1196 | SLIDLQELGKYE | 1207 | 0.0% | 90.4±1181.4 | 109.5±190.6 |
| 1202 | ELGKYEQYIKWP | 1213 | 9.2% | 33.2±54 | 144.4±139.4 |
Таким образом данные, приведенные в таблице выше демонстрируют, что участки шиповидного белка, соответствующие трем пептидам, выбранным Вектором для вакцины, крайне редко вызывают образование антител при ковиде. Критики могут сказать, что пептиды в конкретном эксперименте короче, чем пептиды Вектора. Однако, ни единый эксперимент Вектора, из тех, что описаны в патентах или в публикациях не демонстрирует того, что у реконвалесцентов могут образовываться антитела именно на пептиды ЭпиВакКороны. Казалось бы, такой эксперимент можно провести. Опубликовано уже шесть исследовательских работ по теме, в каждой из которых анализируются наличие антител на множество пептидов шиповидного белка.
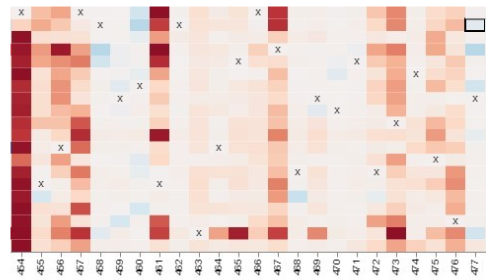
Кроме того, Вектор всегда утверждает, что участки белка, соответсвтующие пептидам ЭпиВакКороны очень консервативны в эволюции. Вот ниже на иллюстрации «тепловая карта» частых аминокислотных замен в участке который соответствует первому пептиду ЭпиВакКороны (участок 454-477), RLFRKSNLKPFERDISTEIYQAGS, который расположен в рецептор-связывающем мотиве рецептор-связывающем домена шиповидного белка. В этом участке очень часто происходят несинонимичные замены. Иногда, они происходят целыми сериями. Как Вам кажется, это консервативный участок? По горизонтали расположены аминокислоты, а по вертикали разные варианты вируса. Цветом указаны частые замены в вариантах, которые влияют на связывание с клеточным рецептором.
Для успешной иммунизации пептидным фрагментом белка конформация используемого пептида должна совпадать с конформацией соответствующего участка в полноразмерном белке. Шиповидный белок коронавируса имеет сложную третичную структуру, что подразумевает стабилизацию элементов вторичной структуры внутримолекулярными водородными связями. Это обстоятельство является препятствием для создания вакцины из фрагментов первичной структуры – необходима имитация микроокружения этих участков белка для конформационного соответствия. На сегодняшний день нет никаких данных о том, что А. Б. Рыжиков и коллеги проводили какую-либо работу в этом направлении.
В растворе пептид 454 RLFRKSNLKPFERDISTEIYQAGS 477 представляет из себя две короткие альфа-спирали, соединенные гибким мостиком из трех остатков – фигура размером 20х13 ангстрем (показанная на иллюстрации структура получена с помощью PEPFOLD).
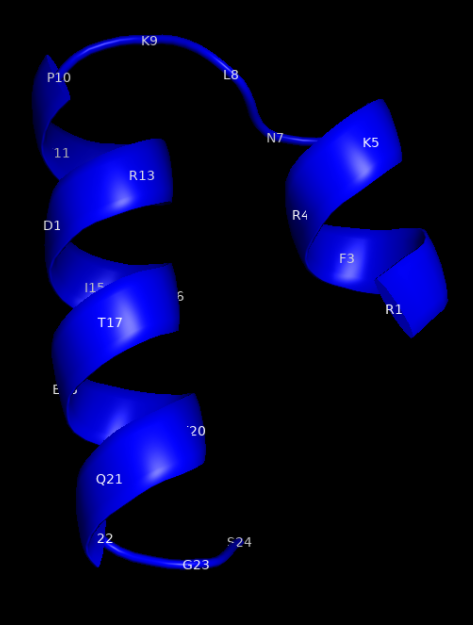
В составе полноразмерного белка данный участок не содержит альфа-спиралей и выглядит как петля неправильной формы размером 26х11 ангстрем, как можно видеть на следующей иллюстрации. Как именно будет выглядеть данный участок после конъюгации с белком-носителем – предсказать невозможно. О какой-либо работе А. Б. Рыжикова и коллег в этом направлении также нет никаких данных.
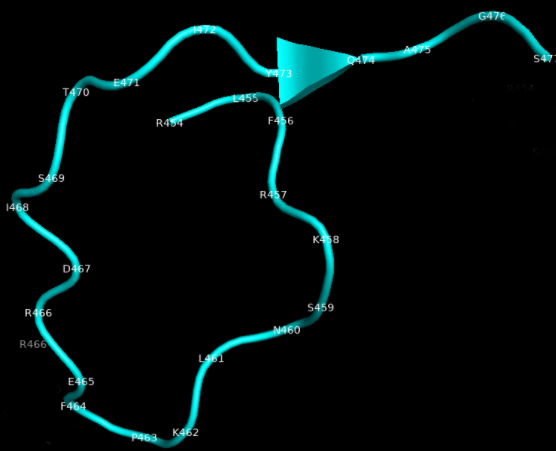
Пептиды из S2-субъединицы более удачны в плане конформационного соответствия, поскольку соотносятся с гептадным повтором 2 (HR2), который состоит из трех альфа-спиралей без третичной структуры. Однако и в этих пептидах обнаружилась проблема: участки, соответствующие им, перекрываются и содержат сайт гликозилирования, попадающий в зоны покрытия обоих пептидов (N1194). Поскольку гликан экранирует часть белка, целесообразность использования такого пептида для иммунизации с целью формирования антител к полноразмерному белку представляется крайне сомнительной.
Ссылки
- Functional mapping of B-cell linear epitopes of SARS-CoV-2 in COVID-19 convalescent population, Zhigang Yi et al., Emerging Microbes and Infections. 2020. P. 1988–1996.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7534331/ - Two linear epitopes on the SARS-CoV-2 spike protein that elicit neutralizing antibodies in COVID-19 patients, Chek M. P. et al., Nat Commun. 2020. P.11. https://www.nature.com/articles/s41467-020-16638-2
- Linear epitopes of SARS-CoV-2 spike protein elicit neutralizing antibodies in COVID-19 patients. Yang Li et al. Cell Mol. Immunol. 2020. P. 1–3. https://www.nature.com/articles/s41423-020-00523-5
- Linear epitope landscape of the SARS-CoV-2 Spike protein constructed from 1,051 COVID-19 patients Yang Li et al. Cell Reports, V. 34, Issue 13, 30 March 2021, 108915 https://www.sciencedirect.com/science/article/pii/S2211124721002291
- Identification of immunodominant linear epitopes from SARS-CoV-2 patient plasma Farrera-Soler L.., PLOS One. 2020. 15(9): e0238089. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0238089
- ShapeViral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity Science 27, Nov 2020: E. Shrock et al. Vol. 370, Issue 6520, eabd4250 https://science.sciencemag.org/content/370/6520/eabd4250
- Фрагменты S-белка из патента RU 2743593 C1 выделены лиловым цветом Иммуногенные и протективые свойства кандидатной пептидной вакцины против SARS-CoV-2, Рыжиков А. Б. И др. Вестник Российской академии медицинских наук. — 2021-04-12. — Т. 76, вып. 1. — С. 5–19 https://vestnikramn.spr-journal.ru/jour/article/view/1528
Все материалы являются частным мнением и оценочным суждением. Не являются официальными данными по вакцинам и лечению. Не являются рекомендацией дл¤ лечения, консультацией, противопоказанием или его отсутствием. Не являются медицинской информацией.
Неофициальная гражданская группа
Входит в систему V1V2.ru
Администратор группы — Андрей Криницкий, krynicki.ru
